《中国药典》2020年版(三部)增修订概述
- 2020-08-31 10:49
- 作者:
- 来源:《中国药品标准》杂志
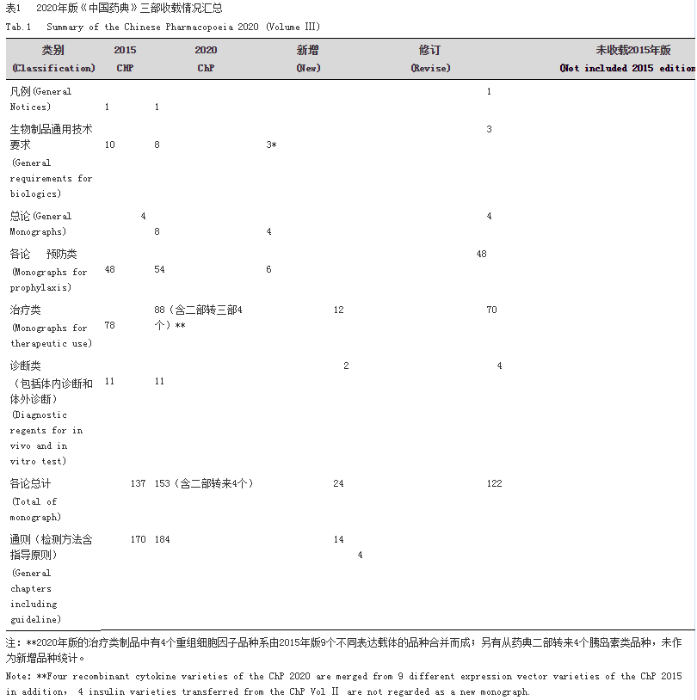
《中华人民共和国药典》(以下简称《中国药典》)2020年版三部的编制工作进一步强化了以科学为基础,以建立“最严谨的标准”为指导,结合生物制品特点,围绕《中国药典》2020年版编制大纲,以临床需求为导向,提高与淘汰相结合,扩大了品种收载范围,强化了质量标准的科学性和先进性,完善了国家药品标准体系,进一步加强了生物制品全过程质量控制的相关要求,推动了现代先进检测技术的应用。本部药典收载的内容包括凡例、生物制品通用技术要求、总论、各论、通则(检测方法)。各部分内容增修订情况见表1。
1 增修订情况
1.1 生物制品通用性技术要求
1.1.1 新增生物制品通用技术要求
本部药典新增“生物制品通用名称命名原则”,“生物制品分包装及贮运管理”和“生物制品病毒安全性控制”通用技术要求。“生物制品病毒安全性控制”是在风险评估基础上结合生物制品各类产品特点,对病毒安全性的综合技术要求,同时兼顾了生产工艺和上市后监测的需求,从生物制品生产全过程质量控制保证生物制品全生命周期的病毒安全性。此外,为规范生物制品通用名称的使用,保证临床使用和流通过程中对生物制品的准确识别,以及对上市药品全生命周期追溯和药物警戒监管,根据我国生物制品实际情况,参照国际通用原则制定了“生物制品通用名称命名原则”。
1.1.2 修订生物制品通用技术要求情况
本部药典收载的“生物制品分包装及贮运管理”是对已收载多年的生物制品分批、分装和冻干、包装以及贮藏和运输规程进行整合、统一和增修订而形成,保持了与现行药品法规变化发展的一致性,同时增强通用性技术要求的系统性、规范性以及与各论的关联。本部药典修订了“生物制品生产检定用菌毒种管理规程”、“生物制品国家标准物质制备和标定规程”以及“血液制品生产用人血浆” 通用技术要求。进一步规范和完善了生物制品生产检定用菌毒种检定的内容,增订了对菌毒种质量控制的原则性要求,扩大了生物制品生产和检定使用的菌毒种目录。“生物制品国家标准物质制备和标定规程”的修订,规范了国家标准物质制备、管理和使用的原则性要求。“血液制品生产用人血浆”增订了混合血浆病毒的核酸检测,加强了血液制品病毒安全性的控制。
1.2 总论
1.2.1 新增总论
本部药典新增了“人用基因治疗制品总论”,“人用聚乙二醇化重组蛋白及多肽制品总论”,“螨变应原制品总论”和人用马免疫血清制品总论。人用马免疫血清制品总论整合了原“免疫血清生产用马匹检疫和免疫规程”中马匹以及免疫血清的质量要求,增加了马免疫血清制品生产工艺和质量控制的技术要求,保证了这类制品质量控制的完整性。人用基因治疗制品,人用聚乙二醇化重组蛋白及多肽制品和螨变应原制品三个总论是针对目前国内上市品种尚少,产品质量控制相对复杂、临床应用前景广泛,暂不适用以单品种各论在中国药典收载的制品情况,以总论形式进行收载。既完善了中国药典生物制品收载范围,同时有助于推动具体品种质量标准的不断完善。
1.2.2 修订总论
本部药典修订了“人用疫苗总论”,“人用重组DNA蛋白制品总论”,“人用重组单克隆抗体总论“和“微生态活菌制品总论”。“人用疫苗总论”针对近年来发展较快的结合疫苗和联合疫苗内容进行了增订,进一步完善了疫苗制品生产工艺内容。“人用重组DNA蛋白制品总论”、“人用重组单克隆抗体总论“和“微生态活菌制品总论”根据近年来这几类制品生产工艺、质量控制以及监管要求的提升,完善了质量标准技术要求的内容。这些总论的修订体现了生物制品全过程质量控制的总体思路,也体现了近年来我国生物制品快速发展的趋势,以及监管要求的不断提升。
1.3 品种各论
1.3.1 新增品种
基于《中国药典》各论收载的原则,《中国药典》三部优先考虑将国家免疫规划疫苗,具有广泛临床应用的生物技术制品进行收载,适当考虑了工艺成熟的新型疫苗、重组抗体和激素类药物及血源筛查用体外诊断试剂等产品的收载。具体新增品种各论见表2。
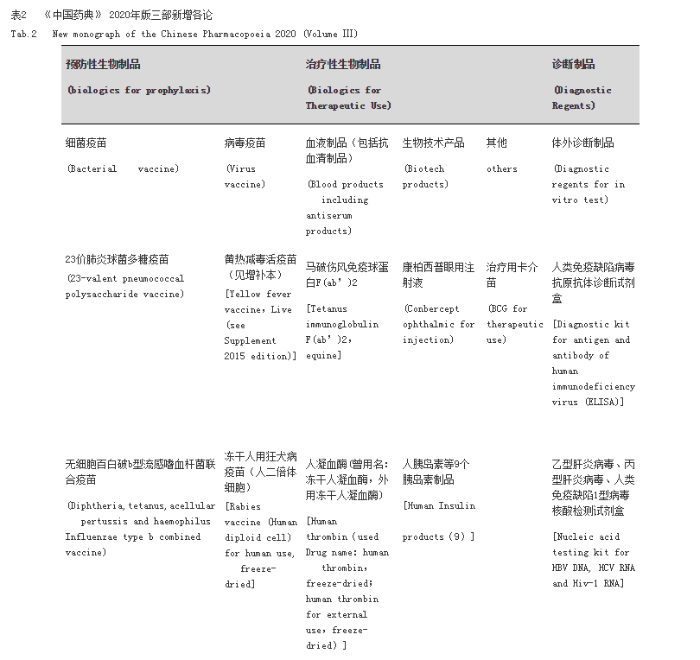

新增预防用生物制品各论中,“Sabin株脊髓灰质炎灭活疫苗(Vero细胞)”为我国自主研制创新的疫苗产品,通过注射途径用于儿童预防脊髓灰质炎病毒的感染,避免了口服疫苗可能带来的疫苗相关病例的缺陷,提高了疫苗接种的安全性。无细胞百白破b型流感嗜血杆菌联合疫苗的收载反映了我国联合疫苗的发展现状和趋势。
新增治疗用生物制品各论中,康柏西普眼用注射液是我国批准的具有自主知识产权的国家一类生物新药,是近年来重组单抗及抗体融合蛋白类产品研发上市的代表品种,满足了临床用药需求,进一步保证了上市产品质量。“治疗用卡介苗”作为治疗用疫苗的代表,在临床应用多年,是疫苗及肿瘤免疫学研究成果的转化,该品种在欧洲药典以细菌为载体的基因治疗产品已收载多年。马破伤风免疫球蛋白F(ab′)2是破伤风抗毒素的升级产品,进一步提高了制品的生物学活性,减少了异源蛋白制品中完整IgG可能引起的临床不良反应风险,进而提高产品的安全性和有效性。体外诊断试剂方面,新增了按照药品管理的人类免疫缺陷病毒抗原抗体诊断试剂盒和乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒1型核酸检测试剂盒。前者作为四代人类免疫缺陷病毒酶联免疫试剂增加了病毒P24抗原的检测,能够较早检出人类免疫缺陷病毒的感染;而后者相对酶联免疫方法能够更早检测出乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒的感染,用于原料血浆采集过程对供血浆者的筛选,进一步提高血浆病毒安全,进而提高我国的血液制品的安全性。
1.3.2 不收载品种基于临床应用的实际情况以及对落后技术的淘汰和产品更新换代,本部药典不再收载上一版(2015年版)品种包括“注射用重组链激酶” 和“梅毒快速血浆反应素诊断试剂”、“梅毒甲苯胺红不加热血清试验诊断试剂”。
1.3.3 修订品种情况本部药典对预防用生物制品和治疗用生物制品100多个品种进行了修订。
预防类生物制品的修订主要体现以下几个方面:①对质量标准和生产工艺控制描述进行了规范和简化;②进一步优化了安全性检测方法,例如对病毒疫苗细胞基质残留蛋白含量和残留DNA测定方法及标准化;③完善病毒减毒活疫苗毒种免疫原性检查,结合药品注册管理要求逐步实现与国际标准的接轨;④明确全基因序列测定在减毒活疫苗质量控制中的应用和要求;⑤结合国家对疫苗上市后不良反应监测的相关要求及国家免疫规划的实施情况,取消疫苗使用说明内容的收载;⑥对细菌类多糖疫苗进一步加强了多糖结构分析与鉴别的质量控制。
治疗类生物制品中生物技术产品的修订主要强化制品与结构的关联,为生物类似药技术要求的实施打下基础;对各论品种通用名进行了规范和统一并增订了结构式/分子式的信息,逐步实现与欧美药典体例上的协调一致;提高重组细胞因子类产品纯度/杂质控制,进一步提升产品质量。血液制品方面,进一步加强了包括动物来源免疫血清制品杂质控制以及有效成分标准的提升。体外诊断试剂的修订是根据体外诊断试剂的特点增加了国家参考品的具体内容,进一步提高试剂的灵敏度和特异性。
1.4 通则(检测方法含指导原则)
1.4.1 新增通则本部药典新增了“单抗电荷变异体测定法(iCIEF法)、单抗N糖谱测定法、黄热减毒活疫苗猴体试验、禽源性病毒荧光定量PCR(Q-PCR)检查法、Sabin株脊髓灰质炎灭活疫苗效力试验(大鼠法)、生物制品生物活性/效价测定方法验证指导原则”等14个通则。这些增订通则补充完善了生物相关检查技术和方法的收载,体现了定量PCR、抗体类药物结构分析方法等新技术在生物制品质量控制中的应用;进一步推动检测方法标准化、规范化,加强了生物测定方法标准化以及与国际标准的协调统一;推动体外分析技术和方法替代动物试验的研究;同时,建立了生物制品质量控制相关技术指导原则,有利于规范生物制品质量控制,同时对新生物制品研发具有指导作用。
1.4.2 修订通则本部药典对“人血白蛋白铝残留量测定法、鼠源性病毒检查法、外源性DNA残留量测定法“等5个通则进行了方法增修订。本版药典通则的修订主要针对技术进步,增加了新的补充方法,进一步完善了相关质量控制的方法。
2 本部药典的特点及思考
2.1 本部药典的特点
2.1.1 生物制品通用性要求内容大幅增加
本版药典新增、整合和修订了多个生物制品通用性技术要求和总论,完善了生物制品通用技术要求的适用范围,全面覆盖已上市生物制品质量控制的各个环节。通过这些通用要求与各论的关联、衔接,在整体框架下平衡了各论的具体要求和标准提高。进一步体现了生物制品全过程、全生命周期质量控制和监管的理念。
2.1.2 生物制品各论收载品种大幅增加
本版药典较上一版药典(2015年版)增加了24个生物制品,涵盖了疫苗、生物技术制品、血液制品和体外诊断试剂等生物制品全类别。充分体现了近年来我国生物医药领域的迅猛发展势头。
2.1.3 大幅提升安全性和有效性控制项目
借鉴国际先进质量控制技术要求,结合我国生物制品实际发展水平,重点加强了安全性和有效性的控制项目的要求,例如通过提高效力测定方法的规范性,在保证方法的准确性和可操作性等方面整体提升了药典标准的水平,全面反映了我国当前生物制品和检测技术的发展水平。
2.1.4 加强了与国际先进标准的协调和统一
加大了对疫苗制品、生物技术产品体例、描述以及质量指标与国际标准的协调和统一,有利于我国生物制品的国际交流,提升《中国药典》的权威性和国际影响力。
2.1.5 《中国药典》导向作用进一步加强
新增人用基因治疗制品总论,人用聚乙二醇化重组蛋白及多肽制品总论等内容,进一步与国际最新先进生物治疗产品接轨,集中体现了当前我国药典标准的最新科研成果。药品工作格局提升,药典导向作用进一步强化,在指导最新生物制品研发,加快生物制品技术发展发挥重要作用。
2.2 本部药典的思考
2.2.1 总体有较大提升,系统性技术要求尚需完善
本部药典较上一版药典在通用技术要求、品种收载、标准提升等方面有较大的提升,进一步实现了与国际先进的技术要求的协调统一,但在生物制品国家标准的系统性技术要求方面尚需进一步完善,此外对于先进治疗产品的质量控制,在检测技术和方法的建立以及方法的先进性、规范性、系统性和完整性等方面有待进一步加强。
2.2.2 质量标准完善,新生物制品研发与收载有待提升
本部药典收载类别比较齐全,质量标准的技术要求与国际标准基本趋于一致。我国在新药领域的新制品的研发速度不断加快,但是相比发达国家仍有一段差距,因此体现在药典收载内容方面,需加快转化近年来生物技术的研究成果,完善用于先进治疗产品的质量控制分析方法。随着我国生物技术的不断进步,药品监管理念的提升,新生物制品研发将不断加快,药品监管开始向罕见病药品研发倾斜,未来《中国药典》生物技术相关要求将会有长足的进步。
3 结语
生物医药技术的发展将成为本世纪医药发展最具活力的领域,快速发展的生物技术是推动《中国药典》和各国质量标准发展的原动力,在保证科学性、规范性和先进性的基础上,《中国药典》还需进一步借鉴发达国家先进的标准管理理念,加大对生物制品质量标准体系研究的深度、广度和力度,加强标准基础研究,不断夯实《中国药典》的科学基础,从而促进我国生物制品整体质量提升。 (摘自《中国药品标准》杂志)
《 》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐













