每周医药看点(6.4-6.10)
- 2021-06-11 13:52
- 作者:刘思慧
- 来源:
讯 国家药监局再次当选为ICH管理委员会成员;八部门联合发布《关于开展国家组织高值医用耗材集中带量采购和使用的指导意见》;国家医保局就《2021年国家医保药品目录调整工作方案》《2021年国家医保药品目录调整申报指南》公开征求意见……6月4日-6月10日,医药行业的这些事情值得关注。
行业政策动态
1.国家医保局、国家发展改革委和国家药监局等八部门发布《关于开展国家组织高值医用耗材集中带量采购和使用的指导意见》。指导意见指出,重点将部分临床用量较大、采购金额较高、临床使用较成熟、市场竞争较充分、同质化水平较高的高值医用耗材纳入采购范围,并根据市场销售情况、临床使用需求以及医疗技术进步等因素,确定入围标准。
2.国家医保局对《2021年国家医保药品目录调整工作方案》《2021年国家医保药品目录调整申报指南》公开征求意见,意见反馈截止日期为6月16日。方案强调将重点考虑2016年1月1日前准入目录,且2016年1月1日至2021年6月30日期间,在国家药品采购平台没有采购记录的药品。在专家评审阶段,国家医保局将对专业组专家意见进行论证,最终确定直接调入、谈判调入、直接调出、可以调出、调整限定支付范围等5方面的药品名单。
3.国家医保局会同财政部、国家税务总局发布《关于做好2021年城乡居民基本医疗保障工作的通知》。通知指出,要推进医保支付方式改革、常态化开展药品集中带量采购、加强医保基金监管,不断提高居民医保基金使用效率;推动DRG和DIP试点城市实际付费,健全谈判药品落地监测机制,今年6月底前完成第二批40%医保增补品种的消化工作;做好国家组织药品耗材集采落地实施,建立医药价格和招采信用评价制度。
4.科技部办公厅、国家卫生健康委办公厅、军委后勤保障部办公厅、国家药监局综合司发布《关于开展第五批国家临床医学研究中心申报工作的通知》,拟开展第五批国家临床医学研究中心申报和认定工作。申报时间截至7月20日。
5.国家药监局再次当选为ICH管理委员会成员。加入ICH 4年来,国家药监部门推动我国充分实施46个ICH指导原则,借鉴国际经验深化药审改革,吸引全球创新资源加速流向中国。中国上市的创新药连续增加,仅2020年就审评通过创新药上市申请20个品种、境外生产原研药品新药上市申请72个品种,国内患者更快更多用上全球新药。
6.CDE就《慢性髓性白血病药物临床试验中检测微小残留病的技术指导原则(征求意见稿)》《基因治疗产品长期随访临床研究技术指导原则(征求意见稿)》公开征求意见。征求意见截止日期为7月3日。
7.CDE发布关于公开征求ICH指导原则《S1B(R1):药物致癌性试验:S1B增补文件》意见的通知。征求意见截止日期为8月31日。
8.CDE公示第四十五批化学仿制药参比制剂目录,涉及多糖铁复合物胶囊等药品。
9.器审中心就《人工智能医疗器械注册审查指导原则(征求意见稿)》公开征求意见,征求意见截止日期为7月16日;就《无源植入性医疗器械货架有效期注册申报资料指导原则(2021年修订)》(征求意见稿)公开征求意见,征求意见截止日期为7月8日;就《体外膜氧合(ECMO)循环套包注册审查指导原则(征求意见稿)》公开征求意见,征求意见截止日期为7月14日。
产品研发/上市信息
1.国家药监局批准微创(上海)医疗机器人有限公司生产的创新产品“三维电子腹腔内窥镜”的注册申请。该产品由腹腔镜头端、腹腔镜管、腹腔镜盒、通信光纤组成。与型号MVS-1080内窥镜图像处理器配合使用,通过视频监视器提供影像供胸腔、腹腔观察、诊断、摄影或治疗用。
2.国家药监局通过优先审评审批程序附条件批准荣昌生物制药(烟台)股份有限公司申报的注射用维迪西妥单抗上市。该药品为我国自主研发的创新抗体偶联药物(ADC),适用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。
3.国家药监局通过优先审评审批程序批准苏州泽璟生物制药股份有限公司申报的1类创新药甲苯磺酸多纳非尼片上市。该药是我国自主研发并拥有自主知识产权的创新药,用于既往未接受过全身系统性治疗的不可切除肝细胞癌患者。
4.美国FDA加速批准Biogen公司产品Aduhelm上市,用于治疗阿尔兹海默病。这是美国自2003年以来批准的首款治疗阿尔茨海默病的药物,也是首款靶向该疾病潜在病理生理学机制的疗法。
5.国家药监局发布2期药品批准证明文件待领信息,共包括99个受理号,涉及北京诺华制药有限公司等企业。(截至6月10日)
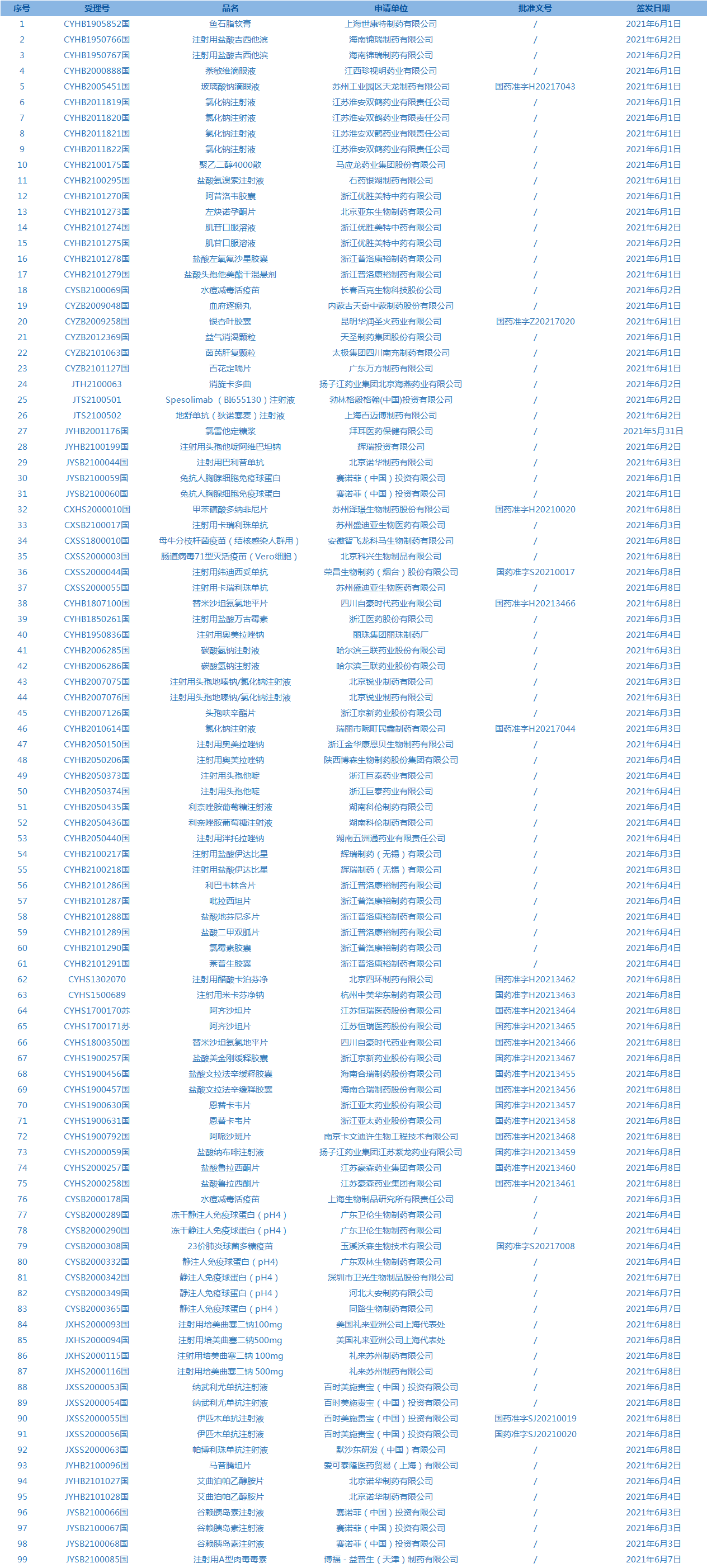
6.国家药监局发布4期医疗器械批准证明文件(准产)待领信息,共包括88个受理号,涉及上海透景生命科技股份有限公司等企业。(截至6月10日)
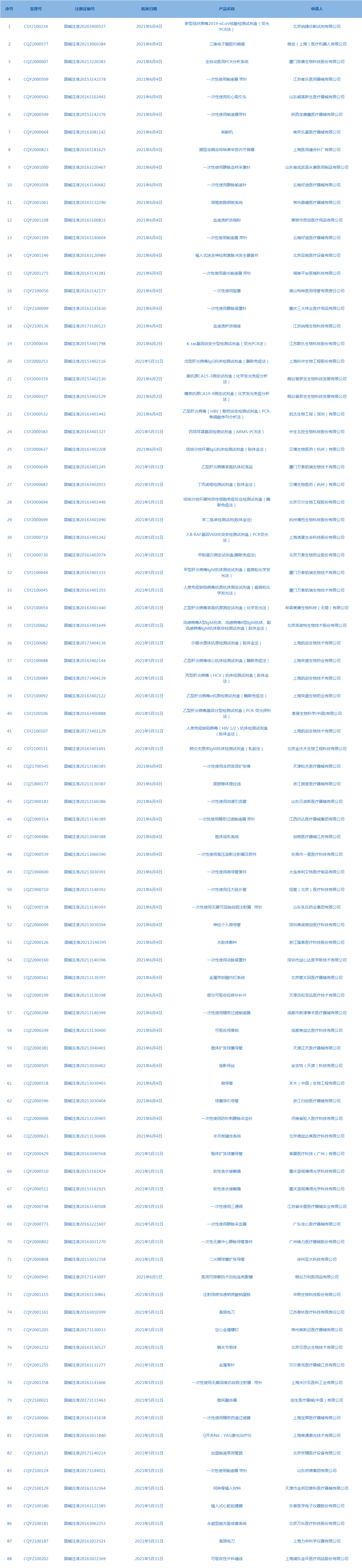
7.CDE网站公示17个仿制药一致性评价任务,涉及盐酸帕洛诺司琼注射液等药品。(截至6月10日)
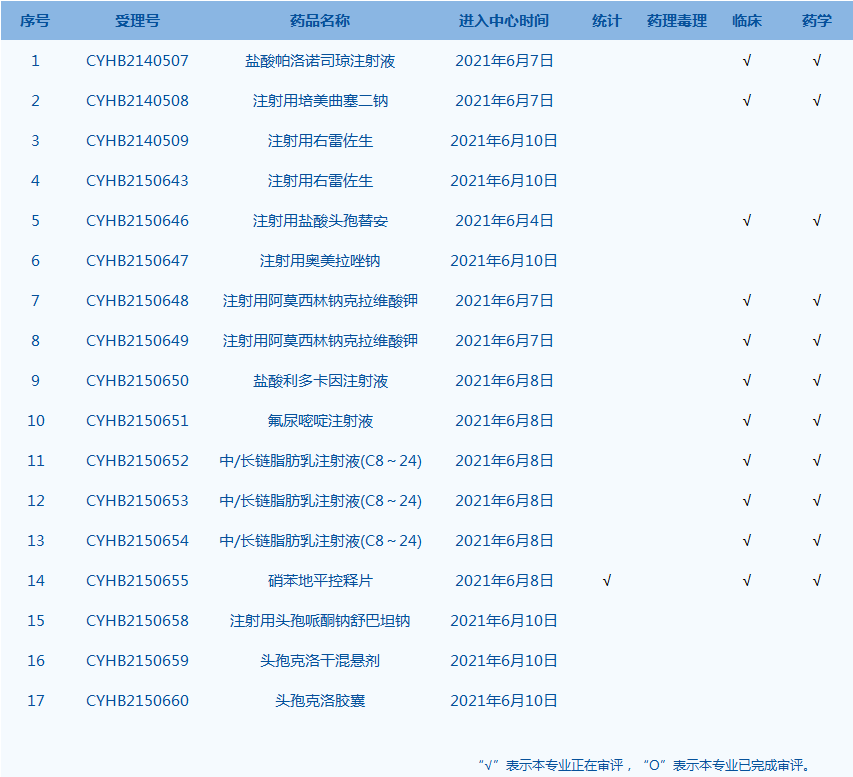
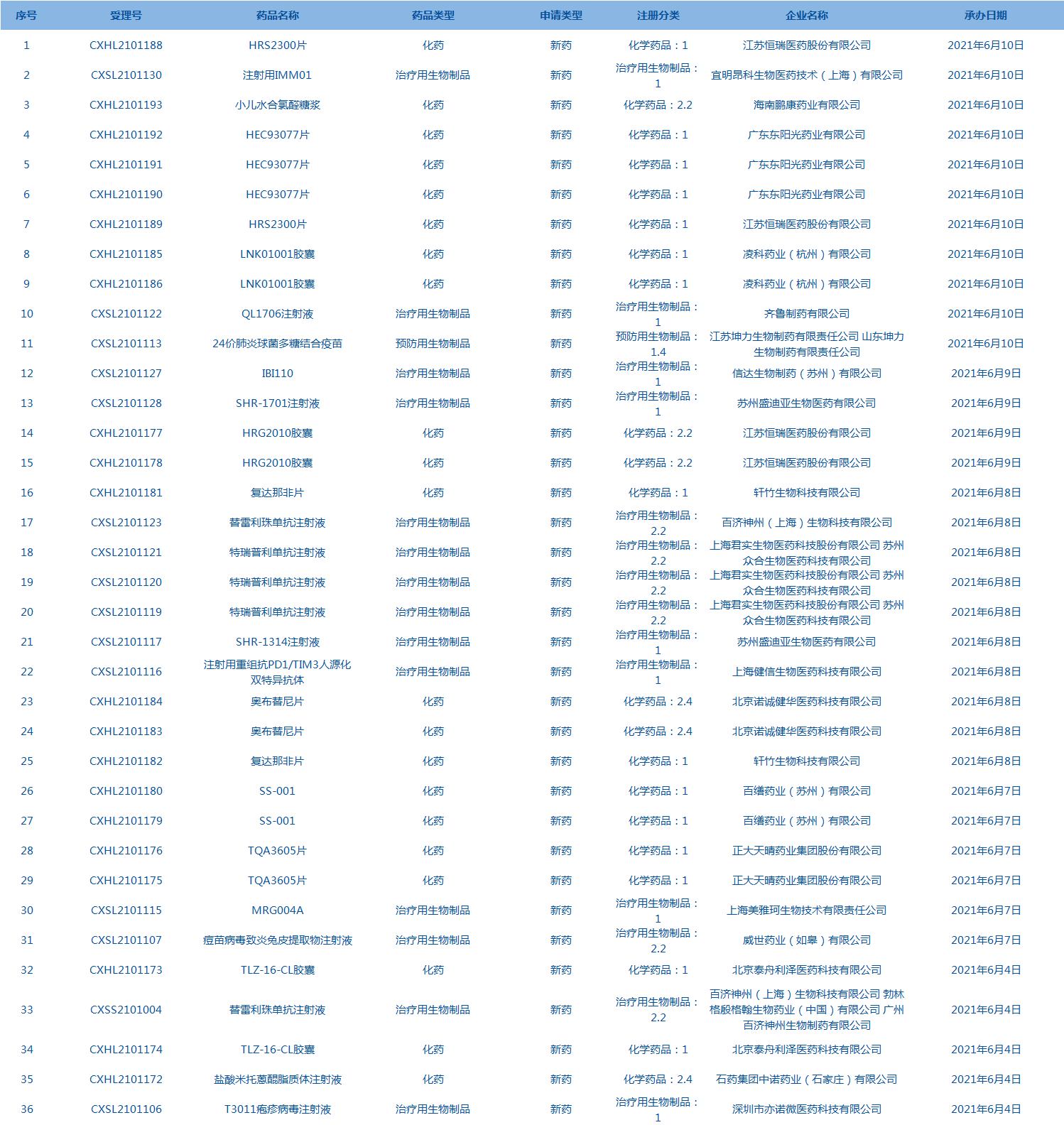
8.CDE承办受理36个新药上市申请,包括HRS2300片等药品。(截至6月10日)
医药企业观察
1.百济神州宣布,新建苏州创新药物产业化基地项目启动奠基。基地总建筑面积超82000平米,预计2023年建成后年产固体制剂10亿片/粒,并具备全球供应能力。基地设计严格遵循中国、美国和欧盟药品生产质量管理规范,并将引入多项先进工艺技术:全面采用全隔离高活产品生产线,多重屏障打造完善的人员健康防护系统,在高活区域内可同时生产不同的高活性抗肿瘤药物;应用自动化物料传送系统,确保不同产品生产所需原辅材料以及最终产品的高效物流输送;具备商业化规模、研发工艺开发和临床用药的柔性生产能力,可在单批次大规模生产和多批次小规模生产之间灵活切换,同时满足新药上市规模量产和临床研究多批小量的复杂需求。
2.百济神州和Shoreline Biosciences宣布达成全球独家战略合作,联动Shoreline的iPSC NK细胞技术与百济神州的临床前研发和临床开发能力,开发并商业化一系列基于NK细胞疗法的产品组合,用于治疗各类恶性肿瘤。
3.药明康德子公司合全药业与亚盛医药签署合作协议,进一步深化战略伙伴关系。根据协议,合全药业将成为亚盛医药在CDMO领域的首选合作伙伴,为亚盛医药在研及后续管线项目提供原料药及制剂产品的工艺开发、生产,新药申报支持以及后期上市药品生产等一站式CMC服务,加快其创新药物的开发。
4.塞力斯医疗与美国Inflammatix,Inc.签署股权认购协议,塞力斯认购Inflammatix 1.63%股权,总认购出资额500万美元,塞力斯获得一个董事会席位(观察员)。同时,双方签署了《技术许可合作协议》,Inflammatix将其所持有的快速分子检测平台(Myrna™)及脓毒症诊断检测芯片(InSep™)相关的专利及技术独家许可授权给塞力斯。
5.霍德生物宣布完成近亿元A++轮融资。本轮融资由元生创投领投,原有股东隆门资本、花城创投跟投。融资将主要用于支持hNPC01前脑神经前体细胞治疗产品,完成针对缺血性脑卒中偏瘫后遗症治疗在中国和美国的临床试验申请(IND)、符合FDA GMP要求的细胞制品生产车间及检验室建设,以及加快其他创新产品及管线的研发。
6.叮当快药宣布完成新一轮融资,融资金额为2.2亿美元。本轮融资由TPG亚洲基金、奥博资本、鸿为资本联合领投,璞林资本、兰馨亚洲、夏焱资本、盈科资本等跟投。融资将被用于推进实施“医+药+险”的健康到家战略,提供依托互联网的多场景、一站式问诊、购药、慢病管理、心理咨询等医疗医药服务。
7.豪思生物宣布完成2亿元B+轮融资。本轮融资由启明创投领投,元生创投、建发新兴投资及老股东远洋资本跟投。本轮融资将主要用于推进公司独家检测产品临床及注册申报,质谱仪器硬件产品研发、增大临床市场推广和宣传。
8.征祥医药宣布完成2亿元A+轮融资。本轮融资由国投招商领投,经纬中国以及醴泽资本跟投。本轮募集资金将用于加速推进公司新一代抗肿瘤药物ZX-101A的全球多中心临床试验,同时完成抗流感新药ZX-7101A和高选择性PI3Kγ抑制剂ZX-4081等临床申报,随即展开临床试验,保证公司管线的核心竞争力。
9.贵州百灵与兰溪瑞康医院有限公司签订《技术开发(合作)合同》,双方拟共同参与医疗机构制剂“糖宁通络片”项目的研究和开发。
10.迪瑞医疗发布公告称,公司产品全自动样品处理系统、蛋白质Sangtec-100测定试剂盒(化学发光免疫分析法)、反三碘甲状腺原氨酸测定试剂盒(化学发光免疫分析法)取得欧盟CE认证。
11.普利制药发布公告称,公司产品注射用泮托拉唑钠获得加拿大卫生部批准上市;特利加压素注射液获得德国联邦药物和医疗器械管理局(BfArM)上市许可。
12.东方基因发布公告称,公司产品Rapid COVID-19 (Antigen) Self-test 新型冠状病毒抗原自测试剂获得英国EUA特殊使用授权。
药械集中采购
1.湖北省发布《关于执行湖北省首批药品集中带量采购结果的通知》,中选药品为23个通用名药品124个品规,并将于2021年6月20日全面执行,同时非中选品种暂停在武汉地区使用。中选品种包括多索茶碱、盐酸左氧氟沙星、环丙沙星、阿莫西林、替卡西林等多个常用的注射剂大品种。与全国最低挂网价相比,中选价最高降幅为85.38%;与湖北省挂网价相比,中选价最高降幅达到96.24%。
2.浙江省医保局就《关于将部分药品调出浙江省基本医疗保险、工伤保险和生育保险药品目录的通知(征求意见稿)》公开征求意见,要求于6月17日前反馈意见。通知明确,自2022年1月1日起,将阿莫西林双氯西林等118个药品调出浙江省医保目录。
3.广西壮族自治区医保局、自治区财政厅发布《关于国家和自治区组织药品集中带量采购工作中医保资金结余留用的实施意见》。该意见适用于国家、省际联盟、自治区组织开展的各批次集采药品品种。根据集采机构中选产品约定采购量和中选价格、非中选产品使用金额,以及统筹地区医保基金实际支付比例和集采通用名药品统筹地区参保患者使用量占比等因素,计算集采机构集采通用名药品医保支出金额,低于集采药品医保资金预算的部分,即为结余测算基数。
4.上海阳光医药采购网发布《全国药品集中采购上海地区补充文件》,涉及企业申报、药品配送、质量检测、三方协议、货款支付、中选药品和非中选药品使用等内容。文件明确,本次集采供应的药品应是临床常用包装,鼓励同时提供满足慢性病常用药2周以上用量包装的药品。对于未中选的最高价药品,在梯度降价后(以中选价托底)方可继续采购使用,价差较大的须进一步加大降价幅度,未中选的非最高价药品,其价格应不高于前述要求调整后的最高价药品价格,实际采购价由生产企业和医疗机构通过挂网公开议价确定。
5.上海阳光医药采购网发布《上海公立医疗机构(部分)药品集中议价采购联盟药品集团采购和集中议价公告》。此次纳入产品数量高达2754个,包括中药、化药、生物药,是有史以来最大规模的一次,涉及采购金额325亿元。
6.甘肃药品耗材采购网发布《甘陕联盟2021年度药品集中带量采购工作实施方案》。明确由甘肃省医保局发起,联合陕西省医保局,代表两省医疗机构组成联盟开展2021年度药品集中带量采购工作。集采优先遴选医保目录内采购金额高、临床使用成熟、可替代性强、市场竞争充分等类型的化学药品,其中同通用名药品已有在国内上市的原研药或通过一致性评价的仿制药(参比制剂),本批集采暂不纳入。【 综合整理/刘思慧】
《 》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐













