每周医药看点(10.8-10.14)
- 2021-10-15 14:16
- 作者:刘思慧
- 来源:
讯 国家药监局发布《儿童化妆品监督管理规定》;抗病毒口服液等药品说明书修订;第四十五批仿制药参比制剂目录发布……10月8日-14日,医药行业的这些事情值得关注。
行业政策动态
1.国家药监局发布《儿童化妆品监督管理规定》,这是我国专门针对儿童化妆品监管制定的规范性文件。《规定》明确除标签要求以外,其他关于儿童化妆品的规定自2022年1月1日起施行。自2022年5月1日起,申请注册或者进行备案的儿童化妆品,必须按照《规定》进行标签标识;此前申请注册或者进行备案的儿童化妆品,未按照《规定》进行标签标识的,化妆品注册人、备案人应当在2023年5月1日前完成产品标签的更新。
2.国家药监局发布《人参、西洋参药材中高锰酸盐检查项补充检验方法》《阿胶益寿口服液中牛皮源成分检查项补充检验方法》2项补充检验方法,药品检验补充检验方法和检验项目(药品补充检验方法)适用于有掺杂掺假嫌疑,且国家药品标准规定的检验方法和检验项目不能检验的药品检验。
3.国家药监局综合司就《关于〈药品管理法〉第一百一十七条第二款适用原则的指导意见(征求意见稿)》公开征求意见。《药品管理法》第一百一十七条第二款对中药饮片不符合标准如何处罚作了专门规定,《征求意见稿》提出适用条款的饮片范畴、适用情形、产品定性、处罚认定、举证责任及判定机制等,拟明确适用条款的仅限于《药品管理法》第九十八条第三款第七项“其他不符合药品标准的药品”的情形,主要包括:性状项中如大小、表面色泽等不符合药品标准的情形;检查项中如灰分、药屑杂质等不符合药品标准的情形。
4.国家药监局发布公告,对抗病毒糖浆、胶囊、丸、片、合剂、颗粒说明书【不良反应】【禁忌】和【注意事项】项进行统一修订,分别明确了处方药、非处方药说明书修订要求。
5.国家药监局发布第四十五批仿制药参比制剂目录,涉及双氯芬酸二乙胺乳胶剂等药品。
6.国家药监局药审中心(CDE)发布《抗HIV感染药物临床试验技术指导原则》,指导和规范抗HIV新药的临床试验,促进创新药物的研发。
7.CDE就《罕见疾病药物临床研发技术指导原则(征求意见稿)》公开征求意见。《征求意见稿》主要适用于化学药品和治疗用生物制品,内容包括罕见疾病药物研发的特殊考虑、临床研发计划、临床试验设计、安全性评估要求、沟通交流等。征求意见截止日期为2021年11月10日。
8.CDE就《人用狂犬病疫苗临床研究技术指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2021年11月12日;就《古代经典名方中药复方制剂毒理学研究技术指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2021年11月11日;就《长效粒细胞集落刺激因子预防化疗后感染临床试验设计技术指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2021年11月10日。
9.CDE公示了第五十批化学仿制药参比制剂目录,包括新增27个参比制剂、41个增补以及21个未通过审议的品种(包括1个参比制剂二次审议未通过)。公示期限为2021年10月9日-21日。
10.国家药监局器审中心就《基因测序仪临床评价注册审查指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2021年10月27日;就《一次性使用内窥镜注射针注册审查指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2021年11月15日。
产品研发/上市信息
1.国家药监局批准了苏州雷泰医疗科技有限公司生产的创新产品“医用电子直线加速器”的注册申请。该产品由辐射头、机架、kV成像系统、MV成像系统、治疗床、主控柜、计算机柜、控制键盘、控制台计算机、隔离变压器、调制器和X射线高压发生器组成,用于对肿瘤患者进行三维适形放射治疗、调强放射治疗、旋转放射治疗、图像引导放射治疗。
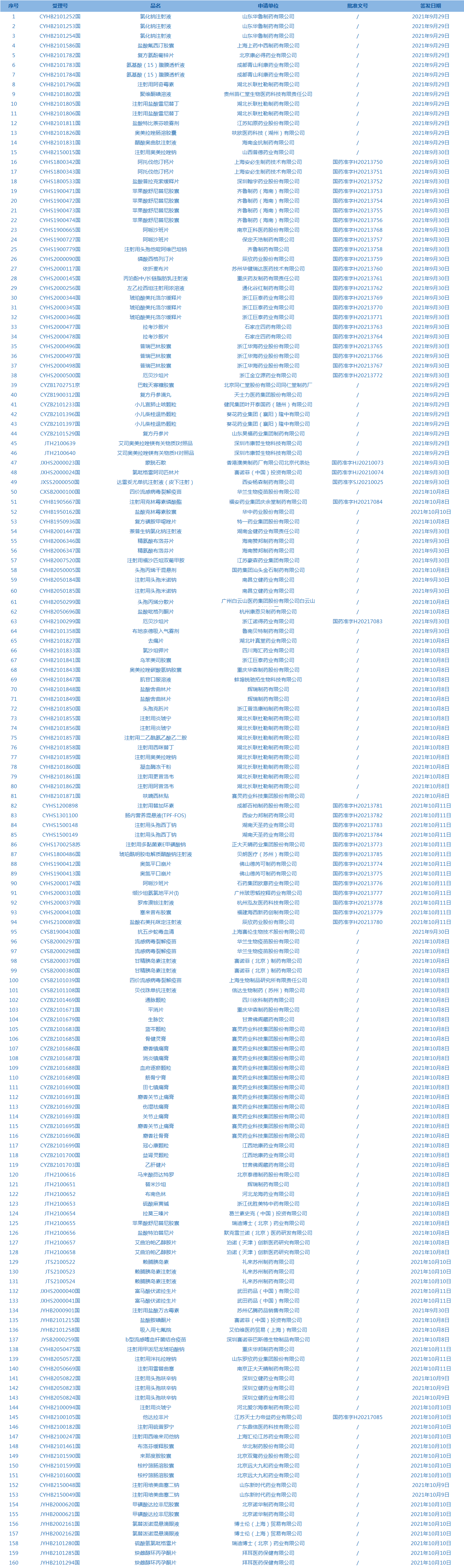
2.国家药监局发布3期药品批准证明文件待领信息,共包括160个受理号,涉及山东华鲁制药有限公司等企业。(截至10月14日)
3.国家药监局发布3期医疗器械批准证明文件(准产)待领信息,共包括25个受理号,涉及广州涞富医疗设备有限公司等企业。(截至10月14日)
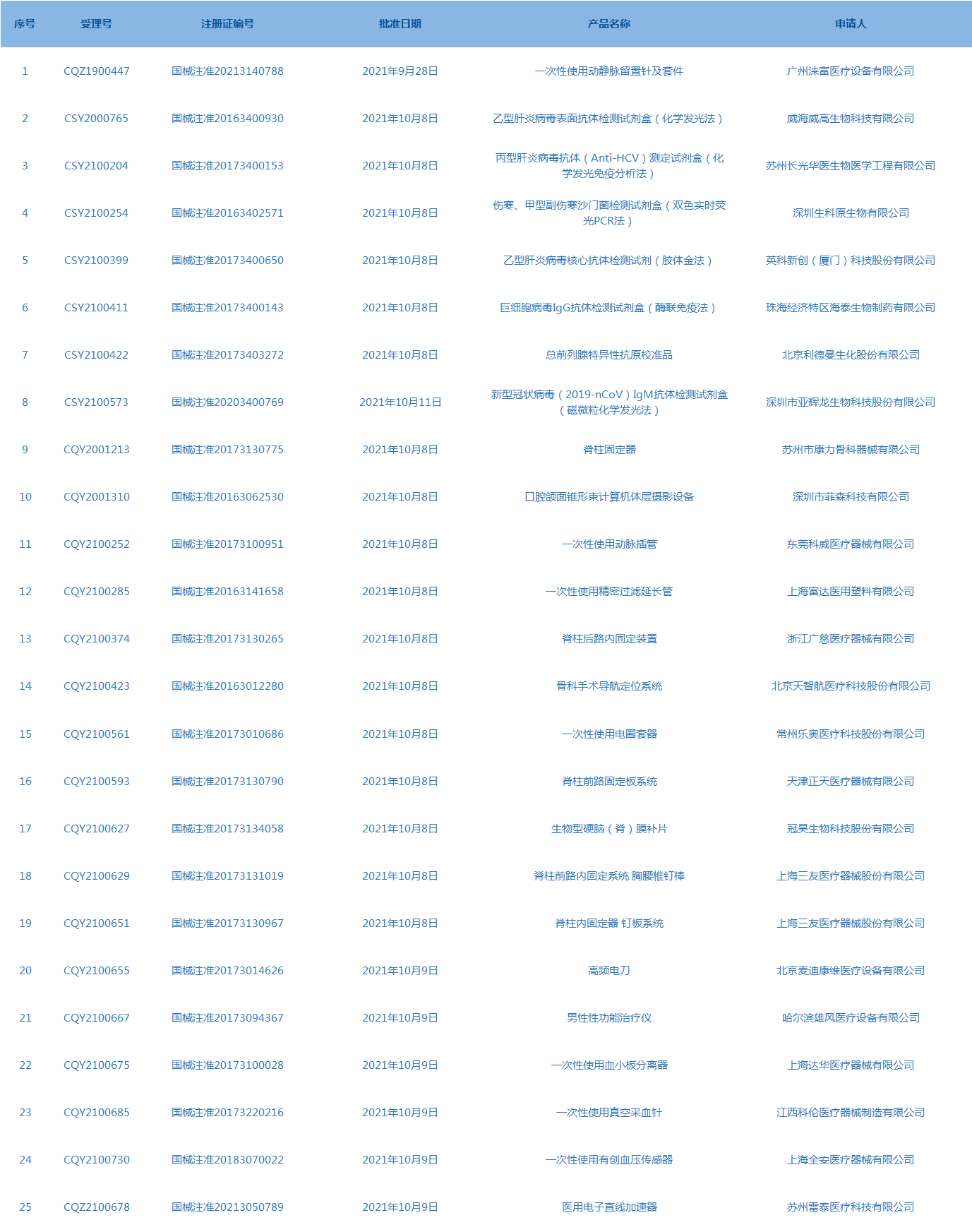
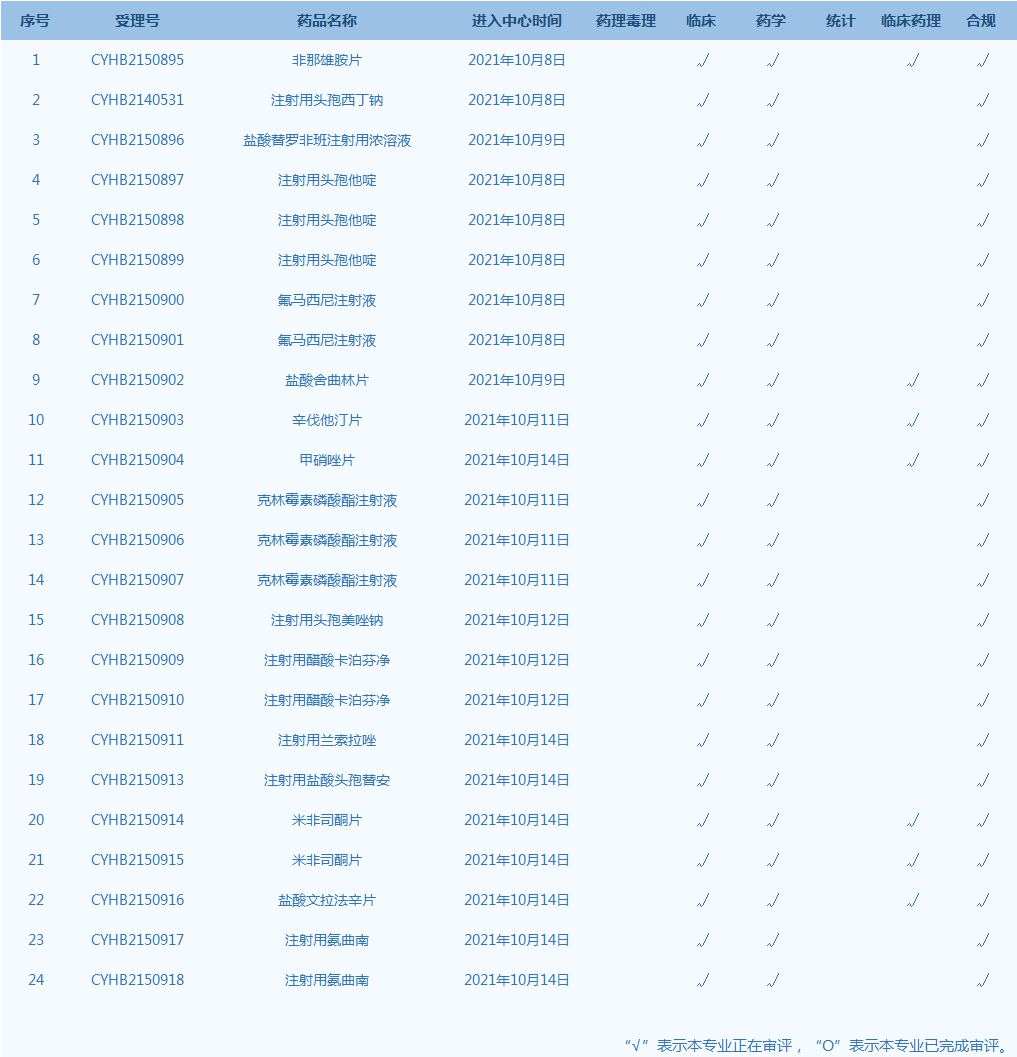
4.CDE网站公示24个仿制药一致性评价任务,涉及非那雄胺片等药品。(截至10月14日)
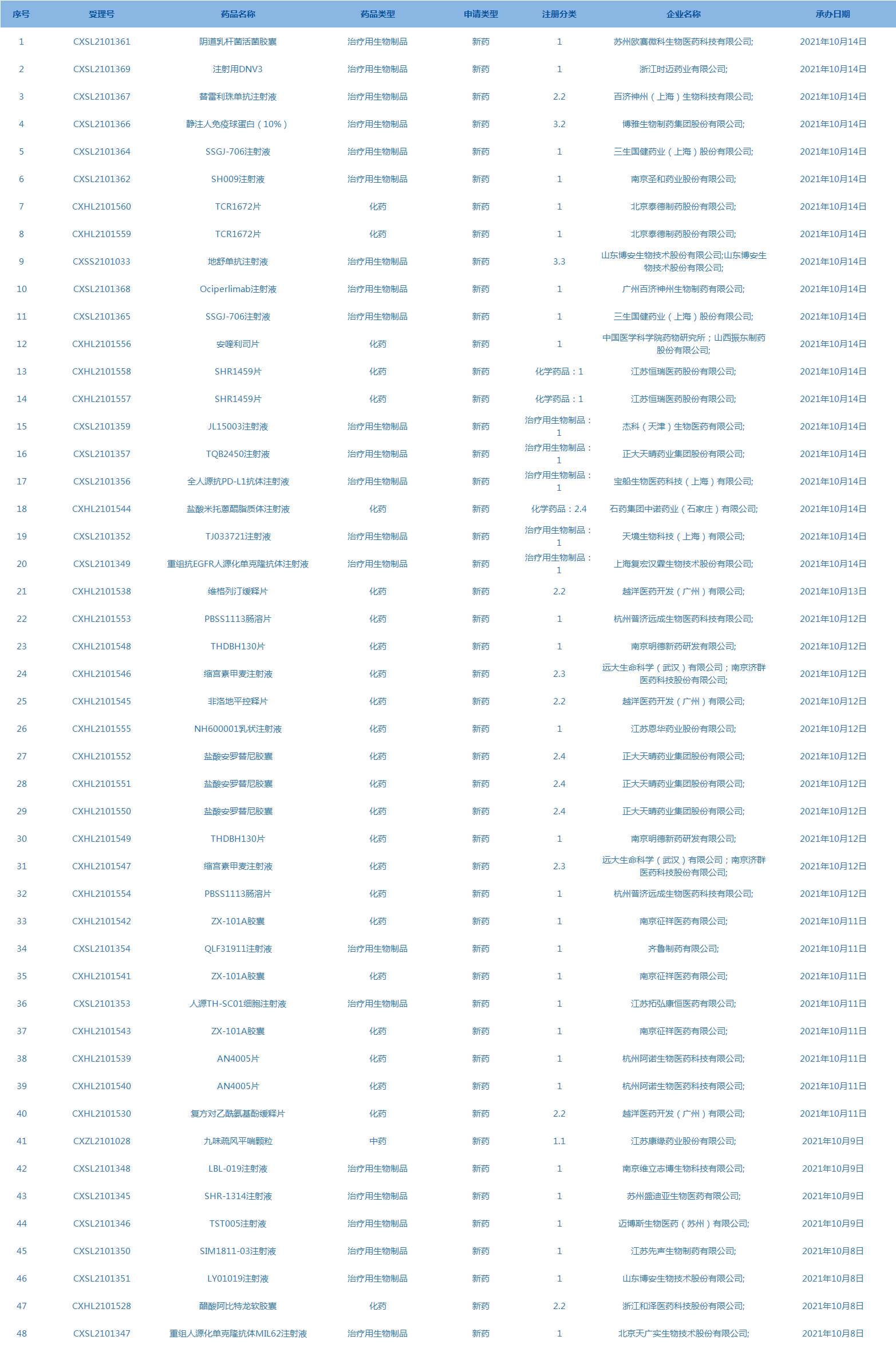
5.CDE承办受理48个新药上市申请,包括阴道乳杆菌活菌胶囊等药品。(截至10月14日)
医药企业观察
1.长春高新发布公告称,其控股子公司金赛药业的金妥利珠单抗注射液(gentulizumab)获得美国FDA授予孤儿药资格,用于治疗急性髓系白血病(AML)。
2.人福医药发布公告称,其全资子公司Epic Pharma, LLC收到美国FDA关于磷酸奥司他韦胶囊的批准文号。
3.深圳华大基因发布公告称,其全资子公司BGI Europe A/S的地中海贫血基因检测试剂盒(联合探针锚定聚合测序法)获得沙特阿拉伯 药品管理局(Saudi Food & Drug Authority,SFDA)批准上市。
4.普利制药发布公告称,收到澳大利亚药物管理局(TGA)签发的注射用伏立康唑(200mg)的上市许可。
5.复星医药拟以人民币15.96亿元的对价转让所持有亚能生物合计29.02%的股权、金石医检所100%股权;同时,本次交易的买方Yaneng Bioscience拟出资人民币3亿元认缴亚能生物新增注册资本634,624港元。本次交易完成后,复星医药持有亚能生物的股权比例将由50.1084%降至19.9976%,亚能生物将由复星医药控股子公司转为联营公司;复星医药将不再持有金石医检所的股权。
6.上海医药集团全资子公司上海上药信谊与贵州生诺及其全资子公司江苏太瑞生诺签订《合作协议》,以不超过人民币6.9亿元(除销售提成外)的交易金额取得新型抑酸剂X842项目原料药及制剂在中国区域的独家委托生产和所有适应症的工业销售权。未来,双方将进一步探讨包括股权投资、联合开发等形式的合作,加快X842及其他在研产品开发和上市工作。
7.翰森制药与Silence Therapeuticsplc订立独家许可合作协议,双方将利用后者的独家mRNAi GOLD™平台,以合作开发针对三个靶点的siRNA。根据公告,这项合作涉及金额超13亿美元。
8.和誉生物于10月14日在港交所挂牌上市,发行价为12.46港元/股。此番上市,和誉生物共引入礼来亚洲基金、 UBS、 BlackRock、清池资本等11个国内外医药领域的知名投资机构作为基石投资者。目前,该公司产品管线涵盖小分子肿瘤精准治疗及小分子肿瘤免疫治疗,共已开发14款候选药物,5款处于临床阶段。
药械集中采购
1.浙江省药械采购平台发布《关于征求浙江省公立医疗机构第二批药品集中带量采购文件意见的通知》,拟开展第二批药品集采,具体品种暂未公布。
2.湖南省医保局、湖南省公共资源交易中心联合发布《关于做好第五批国家组织药品集中带量采购中选结果执行工作的通知》,共计61个中选药品,平均降价幅度56%。其中,利伐沙班片(20mg)和多西他赛注射液(0.5ml:20mg和1ml:20mg)价格降幅超过97%。中选结果于2021年10月25日在全省统一执行。
3.内蒙古自治区医药采购中心发布《关于征询第五批国家组织药品集中采购内蒙古自治区中选品种残缺规格供应意向的通知》,决定对自治区中选的4个品种的4个残缺规格开展价格联动工作,目前征询相关企业供应意向。意向反馈截止日期为2021年10月18日。
4.河南省公共资源交易中心发布《关于公布河南省中部片区联盟药品集中带量采购结果的通知》,同时公布了经济技术标和报价得分,最终12个品规中选。
5.陕西省医保局印发《陕西省推动药品集中带量采购工作常态化制度化开展实施方案》。在药品范围方面,选择临床使用量大、采购金额高、符合临床诊断规范、竞争较为充分的临床常用药品。优先选择国家基本药物和基本医疗保险药品目录内药品。【 综合整理/刘思慧】
《 》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐